Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
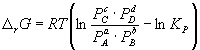 . (9.7)
. (9.7)
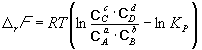 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
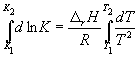 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X = 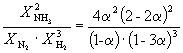 и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =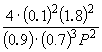 , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
При некоторой температуре энтальпийный и энтропийный факторы реакции могут уравновешиваться, тогда устанавливается состояние равновесия, которому отвечает равенство ∆ r G Т = 0. В этом состоянии свободная энергия системы минимальна, а возможность протекания прямой и обратной реакции равновероятна, при этом в единицу времени получается столько же продуктов реакции, сколько их расходуется в обратной реакции образования исходных веществ. В таких условиях парциальные давления и концентрации всех компонентов реакции будут постоянными во времени и во всех точках системы и называются равновесными давлениями и концентрациями.
Если реакция протекает в изохорно-изотермических условиях, то условием химического равновесия является равенство Δ r F Т = 0. Из уравнений (1.12) и (1.15) следует, что при равновесии химической реакции a A(г)+b B(г)+ d D(к) ↔ e E(г)+ f F(г)
∆ r G 0 Т = - RT ln(p e E равн p f F равн /p a A равн p b B равн) . (2.1)
Если данная гетерогенная реакция с участием газообразных компонентов протекает при постоянном объеме, то
∆ r F 0 Т = - RT ln(c e E равн c f F равн /c a A равн c b B равн) . (2.2)
Если реакция a A(р)+b B(р)+d D(к)=e E(р)+f F(р) протекает в идеальном растворе, то из (1.12а) следует:
∆ r G 0 Т =∆ r F 0 Т = - RT ln(c e E равн c f F равн /c a A равн c b B равн) . (2.3)
Поскольку величины ∆ r F 0 Т и ∆ r G 0 Т для данной температуры есть величины постоянные, то эти уравнения справедливы, если под знаком логарифма находятся постоянные для данной температуры выражения, получившие название констант равновесия К с и К р :
К с = (c e E равн c f F равн /c a A равн c b B равн) (2.4)
К р = (p e E равн p f F равн /p a A равн p b B равн) . (2.5)
Уравнения (2.4) и (2.5) являются математическим выражением закона действующих масс.
Для реакций с газообразными компонентами связь между К р и К с выражается уравнением: К р = К с (RT ) ∆ν , (2.6) где ∆ν =(e+f-a-b ) – изменение числа молей газов в результате реакции, а R = 0,082 атм . л . моль -1. К -1 . Следует обратить внимание, что в выражение для К с и К р не входят компоненты в более конденсированном состоянии (например, вещество D в кристаллическом состоянии).
Константу равновесия К р можно выразить также через равновесные количества молей газообразных компонентов n i равн и общее давление P 0 , при котором проводят изобарно-изотермическую реакцию. Учитывая, что парциальное давление i -ого компонента пропорционально молярной доле этого компонента p i = (n i /Σn i )P 0 , из уравнения (2.5) получаем:
К р =(p e E равн p f F равн /p a A равн p b B равн)=(n e E равн n f F равн /n a A равн n b B равн)(P 0 /Σn i ) ∆ν (2.6)
где Σn i = (n E равн + n F равн + n A равн + n B равн)–сумма равновесных молей всех газообразных компонентов.
Объединяя уравнения (2.1), (2.2), (2.3) с уравнениями (2.4) и (2.5) получаем выражения, часто применяемые для расчетов:
∆ r G 0 Т = - RT lnК р и(2.7)
∆ r F 0 Т = - RT lnК с для газофазныхреакций. (2.8)
∆ r G 0 Т =- RT lnК с для реакций в конденсированных системах. (2.7а)
Таким образом, рассчитав энергию Гиббса реакции для заданной температуры, можно по данным формулам рассчитать К с и К р приэтой температуре. Чем больше величина константы равновесия в данных условиях, тем больше значения равновесных концентраций продуктов реакции, следовательно, тем выше выход продуктов реакции. Под выходом продукта реакции понимают отношение количества (или массы) продукта реакции, которое образовалось в данных условиях, к максимально возможному (теоретически) количеству (или массе) этого продукта при условии полного превращения какого-либо исходного вещества в продукт реакции. Очевидно, что полное (100%) превращение исходного вещества в продукт с термодинамических позиций невозможно, так как при этом константа равновесия становится бесконечно большой.
Под степенью превращения исходного вещества понимают отношение количества (или массы) исходного вещества, которое прореагировало в данных условиях, к начальному количеству (или массе) этого вещества. Если выход продукта стремится к единице (100%), то степень превращения исходного вещества также приближается к единице (100%).
Значения К р и К с при данной температуре не зависят от величин парциальных давлений и концентраций компонентов, а также общего давления в системе, но зависят от температуры. Зависимость константы равновесия от температуры можно выразить в дифференциальной форме:
(d ln K p / dT ) = ∆ r H 0 /(RT 2) , (2.9) где ∆ r Н 0 - стандартная энтальпия реакции, которую в первом приближении считают не зависящей от температуры. Как видно из (2.9), с ростом температуры константа равновесия экзотермической реакции уменьшается, а константа равновесия эндотермической реакции увеличивается.
При интегрировании выражения (2.9) с учетом указанного приближения получаем (при Т 2 > Т 1) формулу
ln(K 2 /K 1) = (∆ r H 0 /R )(1/T 1 – 1/T 2) , (2.10)
из которой следует, что чем больше абсолютная величина теплового эффекта реакции, тем сильнее изменяется значение константы равновесия с изменением температуры. Эту формулу можно использовать также для расчета величины К равн при какой-либо Т 3 , если известны значения К 2 и К 1 при температурах Т 2 и Т 1 .
Пример 10. Запишите выражение дляК с и К р и рассчитайте К р и К с реакции С(к) + СО 2 (г) = 2СО(г) при 298 К и при 1000 К. Сделайте вывод по полученным значениям о выходе продукта реакции при данных температурах и о влиянии температуры на величину константы равновесия.
Решение. Запишем выражения для констант равновесия данной реакции, принимая во внимание, что реакция гетерогенная и вещество графит С(к) находится в твердом состоянии:
К р = p 2 CO равн /p CO 2равн; К с = с 2 CO равн /с CO 2равн
Из уравнения (2.7) имеем K p =exp(-∆G 0 Т /RT) . Используя результаты примера 5, рассчитаем К р для 298 К и 1000 К:
К р 298 = exp(-120 . 10 3 /8,31 . 298)= ехр(-48,5) << 1;
K p 1000 =exp(+316/8,31 . 1000)= ехр(0,038) = 1,039.
По формуле (2.6) находим К с = К р /(RT ) ∆ν = 1,039/0,082 . 1000 = 0,013, так как ∆ν = 2-1=1. По полученным данным можно сделать вывод, что при 298 К константа равновесия К р стремится к нулю, что говорит о том, что в равновесной смеси практически отсутствуют продукты реакции и равновесие реакции сильно смещено в сторону исходных веществ. С ростом температуры величина константы равновесия возрастает (реакция эндотермическая) и при 1000 К К р уже больше 1, то есть в равновесной смеси начинают преобладать продукты реакции, их выход растет с ростом Т.
Пример 11. Для некоторой реакции А(г) = 2В(г), идущей при постоянных давлении и температуре, константа равновесия К р равна 0,02 при 400 К и 4,0 при 600 К. Определите по этим данным ∆ r H 0 298 , ∆ r S 0 298 и ∆ r G 0 298 этой реакции, а также К р при 800 К.
Решение. Пренебрегая зависимостью ∆ r H 0 и ∆ r S 0 от температуры и используя выражения (1.14) и (2.7) составим систему из двух уравнений с двумя неизвестными (T 1 =400 K, T 2 =600 K):
∆ r G 0 Т 1 =∆ r H 0 298 –T 1 ∆ r S 0 298 = -RT 1 lnК р 1 или x – 400y = -8,31.400 ln2 . 10 -2
∆ r G 0 Т 2 =∆ r H 0 298 –T 2 ∆ r S 0 298 = -RT 2 lnК р 2 или x – 600y = -8,31 . 600 ln4
Откуда х = ∆ r H 0 298 = 52833(Дж)= 52,833 кДж; y =∆ r S 0 298 =99,575Дж/К.
Значение К р при 800 К рассчитаем по формуле (2.10). Имеем:
ln(K 800 /K 400) = ln(K 800 /0,02)= (52833/8,31)(1/400 -1/800) = 7,95. Откуда К 800 = 56,55.
Пример 10. Определите температуру, при которой в реакции СаСО 3 (к) = СаО(к) + СО 2 (г) равновесное парциальное давление СО 2 р СО2 = 10 4 Па.
Решение. Для данной гетерогенной реакции запишем выражение для константы равновесия: К р = р СО2 , то есть константа равновесия равна относительному парциальному давлению СО 2 при данной температуре. Для искомой температуры К р =р СО2 = 10 4 /10 5 =0,1.Пренебрегая зависимостью ∆ r H 0 и ∆ r S 0 от температуры, воспользуемся формулами (1.14) и (2.7) и приравняем друг другу два выражения для ∆ r G 0 Т : ∆ r G 0 Т = ∆ r H 0 298 –T ∆ r S 0 298 = -RT lnК р . Значения ∆ r H 0 298 и ∆ r S 0 298 определяем, как рассмотрено выше, по табличным данным: ∆rH 0 298 =178,1 кДж; ∆rS 0 298 =160,5 Дж. Имеем:
178,1 . 10 3 –Т . 160,5
∆rG 0 Т = -8,31Т ln0,1
Решая полученную систему уравнений относительно Т, находим Т =991К
K p = ∏ p i ν i {\displaystyle K_{p}=\prod p_{i}^{{\nu }_{i}}}
Например, для реакции окисления монооксида углерода :
2CO + O 2 = 2CO 2
константа равновесия может быть рассчитана по уравнению:
K p = p C O 2 2 p C O 2 ⋅ p O 2 {\displaystyle K_{p}={\frac {p_{CO_{2}}^{2}}{p_{CO}^{2}\cdot p_{O_{2}}}}} K p = K x P Δ n {\displaystyle K_{p}=K_{x}P^{\Delta n}}где Δn - изменение числа молей веществ в ходе реакции. Видно, что K x зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ ( Δ n = 0 {\displaystyle \Delta n=0} ), то K p = K x {\displaystyle K_{p}=K_{x}} .
Стандартная константа равновесия
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
K 0 = ∏ (p i ~) v i {\displaystyle K^{0}=\prod ({\tilde {p_{i}}})^{v_{i}}} где p i ~ {\displaystyle {\tilde {p_{i}}}} - относительные парциальные давления компонентов, p i ~ = p i / p i 0 {\displaystyle {\tilde {p_{i}}}=p_{i}/p_{i}^{0}} .Стандартная константа равновесия - безразмерная величина. Она связана с K p соотношением:
K p = K 0 (p i 0) Δ n {\displaystyle K_{p}=K^{0}(p_{i}^{0})^{\Delta n}}Видно, что если p i 0 {\displaystyle p_{i}^{0}} выражены в атмосферах, то (p i 0) Δ n = 1 {\displaystyle (p_{i}^{0})^{\Delta n}=1} и K p = K 0 {\displaystyle K_{p}=K^{0}} .
Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям f i 0 = p i 0 {\displaystyle f_{i}^{0}=p_{i}^{0}} = 0,1013 МПа или 1 атм. K f связана с K 0 соотношением:
K f = K 0 (γ i p i 0) Δ n {\displaystyle K_{f}=K^{0}(\gamma _{i}p_{i}^{0})^{\Delta n}} где γ i - коэффициент фугитивности i-го реального газа в смеси.Константа равновесия реакций в гетерогенных системах
FeO т + CO г = Fe т + CO 2гконстанта равновесия (при условии, что газовая фаза идеальна) имеет вид:
K p = p C O 2 p C O {\displaystyle K_{p}={\frac {p_{CO_{2}}}{p_{CO}}}}Термодинамическое описание равновесия
Наряду с обозначением Q для соотношения активностей веществ в произвольный момент реакции t ("коэффициент реакции ")
Q r = { S t } σ { T t } τ { A t } α { B t } β = ∏ a j (t) ν j ∏ a i (t) ν i = ∏ a n (t) ν n {\displaystyle Q_{r}={\frac {\left\{S_{t}\right\}^{\sigma }\left\{T_{t}\right\}^{\tau }}{\left\{A_{t}\right\}^{\alpha }\left\{B_{t}\right\}^{\beta }}}={\frac {\prod a_{j(t)}^{\nu _{j}}}{\prod a_{i(t)}^{\nu _{i}}}}=\prod a_{n(t)}^{\nu _{n}}} (обозначения для приведённой ниже реакции; последнее равенство написано в обозначении, что стехиометрические коэффициент берутся со знаком "+" для продуктов и со знаком "-" для исходных веществ)в химической термодинамике используется обозначение K eq для такого же по форме соотношения между равновесными активностями веществ
K e q = [ S ] σ [ T ] τ [ A ] α [ B ] β = ∏ a j (t = ∞) ν j ∏ a i (t = ∞) ν i = ∏ a n (t = ∞) ν n {\displaystyle K_{eq}={\frac {[S]^{\sigma }[T]^{\tau }}{[A]^{\alpha }[B]^{\beta }}}={\frac {\prod a_{j(t=\infty)}^{\nu _{j}}}{\prod a_{i(t=\infty)}^{\nu _{i}}}}=\prod a_{n(t=\infty)}^{\nu _{n}}} (то есть соотношения активностей в момент t = ∞ {\displaystyle t=\infty } , в момент равновесия). Далее приведено термодинамическое описание химического равновесия и описана связь K eq со стандартной энергией Гиббса процесса.В системе, где протекает химическая реакция
α A + β B ⇌ σ S + τ T {\displaystyle \alpha A+\beta B\rightleftharpoons \sigma S+\tau T}равновесие может быть описано условием
(d G d ξ) T , p = 0 {\displaystyle \left({\frac {dG}{d\xi }}\right)_{T,p}=0} где ξ {\displaystyle \xi } есть химическая переменнаяили, то же самое условие равновесия может быть записано с использованием химических потенциалов как
α μ A + β μ B = σ μ S + τ μ T {\displaystyle \alpha \mu _{A}+\beta \mu _{B}=\sigma \mu _{S}+\tau \mu _{T}}где химические потенциалы
μ A = μ A ⊖ + R T ln { A } {\displaystyle \mu _{A}=\mu _{A}^{\ominus }+RT\ln\{A\}} здесь {A} - строго говоря, активность реагента A; при допущениях об идеальных газах можно заменить их на давления, для реальных газов можно заменить на фугитивности, при допущении о том, что раствор подчиняется закону Генри , можно заменить на мольные доли , и при допущении, что раствор подчиняется закону Рауля - на парциальные давления ; для системы в равновесии может быть заменена на равновесную молярную концентрацию или на равновесную активность. Δ r G o = − R T ln K e q {\displaystyle \Delta _{r}G^{o}=-RT\ln K_{eq}}Равновесный состав смеси и направление реакции
Упомянутый выше "коэффициент реакции" Q (другие обозначения, встречающиеся в литературе - Ω {\displaystyle \Omega } или π {\displaystyle \pi } , "произведение реакции")
Q r = ∏ a n (t) ν n {\displaystyle Q_{r}=\prod a_{n(t)}^{\nu _{n}}}отражает соотношение текущих активностей всех участников реакции и может быть использован для определения направления реакции в момент, для которого известен Q
Если в момент t коэффициент Q > K, то текущие активности продуктов больше равновесных, и значит они должны уменьшиться к тому моменту, когда установится равновесие, то есть в данный момент протекает обратная реакция; Если Q = K, то равновесное состояние достигнуто и скорости прямой и обратной реакций равны; Если Q < K, то v 1 > v − 1 {\displaystyle v_{1}>v_{-1}}
С использованием величины Q r {\displaystyle Q_{r}} записывается уравнение изотермы химической реакции
Δ G p , T = R T ln Q r − R T ln K e q = R T ln Q r K e q = ∑ ν i μ i {\displaystyle \Delta G_{p,T}=RT\ln Q_{r}-RT\ln K_{eq}=RT\ln {\frac {Q_{r}}{K_{eq}}}=\sum \nu _{i}\mu _{i}}Где ν {\displaystyle \nu } - стехиометрические коэффициенты (для продуктов - со знаком "+", для исходных веществ - со знаком "-"; так же, как и в выражениях для Q и K), а μ {\displaystyle \mu } - химические потенциалы а стандартная энергия Гиббса и стандартная константа суть
Δ G p , T o = − R T ln K e q o = ∑ ν i μ i o {\displaystyle \Delta G_{p,T}^{o}=-RT\ln K_{eq}^{o}=\sum \nu _{i}\mu _{i}^{o}}Где μ o {\displaystyle \mu ^{o}} - стандартные химические потенциалы
Уравнение изотермы показывает, как величина Q связана с изменением свободной энергии реакции:
При
Q
>
K
{\displaystyle Q>K}
для прямой реакции
Δ
G
>
0
{\displaystyle \Delta G>0}
, то есть
∑
ν
j
μ
j
{\displaystyle \sum \nu _{j}\mu _{j}}
для продуктов прямой реакции больше, чем для исходных веществ - это означает, что прямая реакция запрещена (значит, не запрещена обратная);
при
Q
=
K
{\displaystyle Q=K}
для прямой реакции
Δ
G
=
0
{\displaystyle \Delta G=0}
, то есть реакция достигла равновесного состояния;
при
Q
<
K
{\displaystyle Q
Величина по определению имеет смысл только для состояния равновесия, то есть для состояния с v 1 v − 1 = 1 {\displaystyle {\frac {v_{1}}{v_{-1}}}=1} и Δ G r = 0 {\displaystyle \Delta G_{r}=0} . Величина K e q {\displaystyle K_{eq}} ничего не говорит о скоростях реакций, но она описывает состав системы в состоянии равновесия.
Если K >> 1, то в системе преобладают продукты (прямой) реакции Если K << 1, то в системе преобладают исходные вещества (продукты обратной реакции)
Стандартные состояния
Стандартная энергия Гиббса реакции в газовой смеси - энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм). Стандартная энергия Гиббса реакции в растворе - энергия Гиббса при стандартном состоянии раствора, за которое принимают гипотетический раствор со свойствами предельно разбавленного раствора , но с концентрацией всех реагентов, равной единице. Для чистого вещества и жидкости стандартная энергия Гиббса совпадает с энергией Гиббса образования этих веществ. Величина стандартной энергии Гиббса реакции может быть использована для приближенной оценки термодинамической возможности протекания реакции в данном направлении, если начальные условия не сильно отличаются от стандартных. Кроме того, сравнивая величины стандартной энергии Гиббса нескольких реакций, можно выбрать наиболее предпочтительные, для которых имеет наибольшую по модулю отрицательную величину.
Кинетическое описание
Для обратимой химической реакции константа равновесия K eq может быть выражена через константы скорости прямых и обратных реакций. Рассмотрим элементарную обратимую химическую реакцию первого порядка
A ⇄ B {\displaystyle \mathrm {A} \rightleftarrows \mathrm {B} }По определению, равновесие задаётся условием v 1 = v − 1 {\displaystyle v_{1}=v_{-1}} , то есть равенством скоростей прямой и обратной реакций.
В соответствии с законом действующих масс v = k ∏ a j n j {\displaystyle v=k{\prod }{a_{j}}^{n_{j}}}
Где k - константа скорости соответствующей реакции, а a j n j {\displaystyle {a_{j}}^{n_{j}}} - равновесные активности реагентов этой реакции, возведённые в степени, равные их стехиометрическим коэффициентам
можно записать условие равновесия в виде
1 = v 1 v − 1 = k 1 ∏ a A n A k − 1 ∏ a B n B {\displaystyle 1={\frac {v_{1}}{v_{-1}}}={\frac {k_{1}{\prod }{a_{A}}^{n_{A}}}{k_{-1}{\prod }{a_{B}}^{n_{B}}}}} 1 = k 1 k − 1 ⋅ ∏ a A n A ∏ a B n B = k 1 k − 1 ⋅ (K e q) − 1 {\displaystyle 1={\frac {k_{1}}{k_{-1}}}\cdot {\frac {\prod {a_{A}}^{n_{A}}}{\prod {a_{B}}^{n_{B}}}}={\frac {k_{1}}{k_{-1}}}\cdot \left(K_{eq}\right)^{-1}}(см. термодинамическое описание константы равновесия), что возможно только если
K e q = k 1 k − 1 {\displaystyle K_{eq}={\frac {k_{1}}{k_{-1}}}}Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики .
Множественные равновесия
В случае, когда в системе устанавливается сразу несколько равновесий (то есть одновременного или последовательного протекает нескольких процессов), каждый из них может быть охарактеризован своей константой равновесия, из которых можно выразить общую константу равновесия для всей совокупности процессов. Можно рассмотреть такую ситуацию на примере ступенчатой диссоциации двухосновной кислоты H 2 A. Водный раствор её будет содержать частицы (сольватированные) H + , H 2 A, HA - and A 2- . Процесс диссоциации протекает в две ступени:
H 2 A ⇌ H A − + H + : K 1 = [ H A − ] [ H + ] [ H 2 A ] {\displaystyle H_{2}A\rightleftharpoons HA^{-}+H^{+}:K_{1}={\frac {}{}}} H A − ⇌ A 2 − + H + : K 2 = [ A 2 − ] [ H + ] [ H A − ] {\displaystyle HA^{-}\rightleftharpoons A^{2-}+H^{+}:K_{2}={\frac {}{}}}K 1 и K 2 - константы первой и второй ступеней диссоциации соответственно. Из них можно выразить "полную" константу равновесия, для процесса полной диссоциации :
H 2 A ⇌ A 2 − + 2 H + : K 1 + 2 = [ A 2 − ] [ H + ] 2 [ H 2 A ] = K 1 K 2 {\displaystyle H_{2}A\rightleftharpoons A^{2-}+2H^{+}:K_{1+2}={\frac {^{2}}{}}=K_{1}K_{2}}Другой пример множественного равновесия - анализ системы осадок /растворимое комплексное соединение . Допустим, имеется равновесие
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons AgI(solid)+I^{-}(aq)}Реакцию можно представить в виде двух последовательных равновесий - равновесия разложения комплексного иона на составляющие его ионы, которое характеризуется "константой нестойкости" (величина, обратная "константе устойчивости" β):
A g I 2 − (a q) ⇌ A g + (a q) + 2 I − (a q) : K 1 = α A g + α I − 2 α A g I 2 − = β − 1 {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons Ag^{+}(aq)+2I^{-}(aq):K_{1}={\frac {\alpha _{Ag^{+}}\alpha _{I^{-}}^{2}}{\alpha _{AgI_{2}^{-}}}}=\beta ^{-1}}и равновесия перехода ионов из объёма растворителя в кристаллическую решётку
A g + (a q) + I − (a q) ⇌ A g I (s o l i d) : K 2 = α A g I α A g + α I − {\displaystyle Ag^{+}(aq)+I^{-}(aq)\rightleftharpoons AgI(solid):K_{2}={\frac {\alpha _{AgI}}{\alpha _{Ag^{+}}\alpha _{I^{-}}}}}с учётом того, что для твёрдых веществ активность принимается равной 1 , а в разбавленных растворах активности могут быть заменены на молярные концентрации, получаем
K 2 = α A g I α A g + α I − = 1 [ A g + ] [ I − ] = 1 K s p {\displaystyle K_{2}={\frac {\alpha _{AgI}}{\alpha _{Ag^{+}}\alpha _{I^{-}}}}={\frac {1}{}}={\frac {1}{K_{sp}}}}где K s p {\displaystyle K_{sp}} - произведение растворимости
Тогда суммарное равновесие будет описываться константой
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) : K = α A g I α I − α A g I 2 − = K 1 ⋅ K 2 = 1 β ⋅ K s p {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons AgI(solid)+I^{-}(aq):K={\frac {\alpha _{AgI}\alpha _{I^{-}}}{\alpha _{AgI_{2}^{-}}}}=K_{1}\cdot K_{2}={\frac {1}{\beta \cdot K_{sp}}}}И значение этой константы будет условием преобладания в равновесной смеси комплексного соединения или твёрдой соли: как и выше, если K << 1, то в равновесной смеси большая часть ионов связана в комплексное соединение, если K >> 1, то в равновесном состоянии в системе большая часть ионов связана в кристаллической фазе. реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если Δ H > 0 {\displaystyle \Delta H>0} (тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия d ln K p d T {\displaystyle {\frac {d\ln K_{p}}{dT}}} тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).
Методы расчета константы равновесия
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG 0 ), а затем использованию формулы:
Δ G 0 = − R T ln K 0 {\displaystyle \Delta G^{0}=-RT\ln K^{0}} , где R {\displaystyle R} - универсальная газовая постоянная .При этом следует помнить, что энергия Гиббса - функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG 0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG 0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Энтропийный метод расчёта ΔG реакции является одним из самых распространённых и удобных . Он основан на соотношении:
Δ G T = Δ H T − T Δ S T {\displaystyle \Delta G_{T}=\Delta H_{T}-T\Delta S_{T}}или, соответственно, для стандартного изменения энергии Гиббса:
Δ G T 0 = Δ H T 0 − T Δ S T 0 {\displaystyle \Delta G_{T}^{0}=\Delta H_{T}^{0}-T\Delta S_{T}^{0}}Здесь ΔH 0 при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны - см., например, уравнение Кирхгофа :
Δ H T 0 = Δ H 298 0 + ∫ 298 T Δ C p d T {\displaystyle \Delta H_{T}^{0}=\Delta H_{298}^{0}+\int _{298}^{T}\Delta C_{p}dT}Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
- По термическим данным - с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
Итак, если известны Δ H 298 0 {\displaystyle \Delta H_{298}^{0}} , Δ S 298 0 {\displaystyle \Delta S_{298}^{0}} и температурные зависимости теплоёмкости, Δ G T 0 {\displaystyle \Delta G_{T}^{0}} может быть рассчитано по формуле:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + ∫ 298 T Δ C p d T − T ∫ 298 T Δ C p d T T {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}+\int _{298}^{T}\Delta C_{p}dT-T\int _{298}^{T}\Delta C_{p}{\frac {dT}{T}}}Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + Δ C p 298 (T − 298) − T ln T 298 {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}+\Delta C_{p~298}(T-298)-T\ln {\frac {T}{298}}}И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}}Переход от Δ G T 0 {\displaystyle \Delta G_{T}^{0}} к константе равновесия осуществляется по приведённой выше формуле.
Многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне
Химически обратимые реакции первоначально протекают в одном направлении за счет взаимодействия между собой исходных веществ. По мере накопления продуктов реакции они начинают взаимодействовать между собой с образованием исходных веществ.
Рассмотрим обратимую реакцию, в которой порядок реакции по каждому из веществ совпадает со стехиометрическими коэффициентами.
а (A) + b (B) = c (C) + d (D)
Графическая зависимость скоростей прямой (V 1) и обратной (V 2) реакций обратимого химического процесса от времени
В результате в системе устанавливается химическое равновесие, и концентрации исходных и конечных веществ перестают изменяться. Неизменность концентраций веществ во времени может наблюдаться также в случае очень медленно протекающих реакций. Но такое состояние не является истинным химическим равновесием. Признаки истинного химического равновесия :
1. состояние системы остается неизменным во времени при отсутствии внешних воздействий;
2. состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
3. состояние системы не зависит от того, с какой стороны она подходит к равновесию.
Положение химического равновесия – это достигнутое при равновесии соотношение концентраций реагирующих веществ, которое неизменно для данного состояния. Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P.
Состояние химического равновесия описывается законом действующих масс .
При достижении равновесия отношение произведения концентраций (парциальных давлений) продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам, к произведению концентраций исходных веществ также в степенях, соответствующих стехиометрическим коэффициентам, представляет собой константу . Она зависит только от природы реагирующих веществ и температуры. Константа, выраженная через равновесные концентрации C i обозначается K с, а выраженная через парциальные давления P i – K р.
Для гомогенного процесса
а (А) + b (В) = d (D) + k (K)
K
с =  или K
р =
или K
р =  .
.
Для гетерогенного процесса
а (А) + b (В) = с [C] + d (D)
K
с =  или K
р =
или K
р =  .
.
Концентрация вещества С в процессе взаимодействия не изменяется, поэтому не включается в выражение константы равновесия (С не является действующей массой).
Выражение для К с и К р представляет собой математическое выражение закона действующих масс применительно к обратимым процессам.
Используя уравнение Менделеева-Клапейрона РV= (m / M) RT, преобразование которого
дает связь между К с и К р:
К р = К с (RT) D n ,
Dn разность между количеством образовавшихся газообразных продуктов и количеством исходных газообразных веществ.
По значению константы химического равновесия можно судить о глубине протекания процесса к моменту достижения равновесия.
В расчетах, связанных с использованием констант равновесия K с , в предлагаемых задачах используются понятия равновесные и исходные концентрации, изменения концентраций. Равновесными называют концентрации реагирующих веществ в состоянии химического равновесия (С ), исходными считают заданные до начала реакции концентрации веществ (С 0). Равновесные концентрации реагентов (С ) связаны с их исходной концентрацией (С 0) уравнением С = С 0 – DС , где DС – количество исходного вещества которое прореагировало до наступления состояния равновесия.
Пример 1 . Равновесие реакции 2(NO) + (O 2) = 2(NO 2) установилось при следующих концентрациях реагирующих веществ: C NO = 0,02 моль/л; С О = 0,01 моль/л; С NO = 0,01 моль/л. Вычислить константу равновесия и исходные концентрации NO и О 2 .
Решение . Для расчета константы химического равновесия подставим значения равновесных концентраций всех реагирующих веществ в выражение K с :
K с
=  =
=  = 0,25.
= 0,25.
Найдем исходные концентрации NO и O 2 по соотношению С 0 = С + DС . Для определения исходных концентраций каждого из веществ нужно вычислить значения DС . Из уравнения реакции видим, что из 2 молей NO в результате реакции образуется 2 моля NО 2 , следовательно, на образование 0,01 моля NО 2 к моменту установления равновесия расходовалось 0,01 моля NО. Равновесная концентрация NO составляет 0,02 моль/л, значит, C 0(NO) = 0,02 + 0,01 = 0,03 моль/л. Рассуждая аналогично, получим значение DС О = 0,005 моль/л, так как по уравнению реакции 1 моль О 2 расходуется при образовании 2 молей NО 2 . C 0(О ) = 0,01 + 0,005 = 0,015 моль/л.
Пример 2 . Исходные концентрации оксида углерода (IV) и водорода равны соответственно 6 моль/л и 4 моль/л. Константа равновесия процесса (СО 2) + (Н 2) = (СО) + (Н 2 О) равна 0,5. Вычислить равновесные концентрации всех веществ.
Решение
K с
=  .
.
Обозначим DС СО , концентрацию прореагировавшего СО 2 к моменту равновесия за х . Тогда С СО = 6 – х . С 1 молем СО 2 взаимодействует 1 моль Н 2 , поэтому количество прореагировавшего водорода в реакции также будет х, С Н = 4 – х .
Из уравнения реакции следует, что из 1 моля СО 2 образуется 1 моль СО, а из 1 моля водорода – 1 моль Н 2 О, следовательно, концентрации образовавшихся веществ будут равны по х (моль/л).
Подставив значения равновесных концентраций в выражение константы, решим его относительно х :
0,5 =  , откуда х
= 2 моль/л.
, откуда х
= 2 моль/л.
Значит, количество прореагировавших СО 2 и Н 2 и образовавшихся СО и Н 2 О составляет 2 моль/л.
Равновесные концентрации СО 2 и Н 2 соответственно равны:
6 – 2 = 4 моль/л и 4 – 2 = 2 моль/л.
Пример 3 . Исходная концентрация вещества А в системе (А) = 2(В) составляет 2 моль/л. Равновесие установилось, когда прореагировало 20%исходного вещества. Вычислить константу равновесия процесса.
Решение . Запишем выражение константы равновесия:
K с = .
Вычислим значения равновесных концентраций веществ А и В. Из условия задачи следует, что количество прореагировавшего вещества А составляет 20%от исходного количества, т. е. DС А = = 0,2 × 2 = 0,4 моль/л. Равновесная концентрация вещества А определяется как разность С 0(А) – DС А = 2 – 0,4 = 1,6 моль/л. Из 1 моля А образуется 2 моля В. Следовательно, если к моменту установления равновесия расходовано 0,4 моль/л вещества А, то образовалось 0,8 моль/л вещества В. Тогда С В = 0,8 моль/л.
Подставим значения равновесных концентраций в выражение константы равновесия и получим величину константы:
K с = = 1,6.
ЭНТРОПИЯ
Возможность самопроизвольного протекания химического процесса определяется двумя факторами: стремлением системы к понижению внутренней энергии за счет экзотермической реакции (-DH ) и стремлением системы к увеличению неупорядоченности в расположении частиц за счет теплового движения. При низких температурах преобладает стремление к минимуму энергии. При высоких температурах за счет усиления хаотического движения частиц вещества главную роль начинает играть фактор повышения неупорядоченности, мерой которой является функция состояния, называемая энтропией.
Энтропия (S) - термодинамическая функция, однозначно характеризующая состояние системы независимо от ее предыстории. Она является количественной мерой неупорядоченности системы, мерой хаотического движения и взаимного расположения частиц. Энтропия зависит от природы вещества, его количества (концентрации), давления и температуры. В отличие от внутренней энергии и энтальпии можно определить абсолютное значение энтропии.
В изолированных системах (где обмен с окружающей средой энергией и массой невозможен) процессы самопроизвольно протекают лишь в сторону повышения энтропии (второе начало термодинамики ). Т.е. в изолированных системах изменение энтропии может использоваться для определения направления самопроизвольного протекания процесса.
Энтропия вещества в определенном состоянии (при заданных параметрах) в определенном агрегатном состоянии (газ, жидкость, твердое) пропорциональна логарифму термодинамической вероятности нахождения вещества в этом состоянии (уравнение Больцмана):
S = k ln W,
Где k = R / N A , W – термодинамическая вероятность состояния, которая определяется числом микросостояний, с помощью которых может быть реализовано данное макросостояние.
В идеальном кристалле при абсолютном нуле Т=0К, движение прекращается, положение частиц остается неизменным, и вероятность состояния системы может быть только одна. Следовательно, энтропия идеального кристалла при абсолютном нуле S=0.
Третье начало термодинамики гласит, что энтропия беспримесного идеального кристаллического тела при температуре 0 К равна нулю.
Стандартной считается энтропия, отнесенная к 1 молю вещества при стандартных условиях (давление 1 атм (101,32 кПа) и температура 298 К (25 О С)). Значения стандартных энтропий для большинства химических соединений представлены в справочной литературе. Единицей измерения энтропии, как правило, является Джоуль на моль-кельвин (Дж /(моль К)).
Произвольную обратимую химическую реакцию можно описать уравнением вида:
aA + bB Û dD + eE
В соответствии с законом действующих массв простейшем случае скорость прямой реакции связана с концентрациями исходных веществ уравнением
v пр = k пр С А а С В b ,
а скорость обратной реакции - с концентрациями продуктов уравнением
v обр = k обр С D d С E e .
При достижении равновесия эти скорости равны друг другу:
v пр = v обр
Отношение друг к другу констант скорости прямой и обратной реакций будет равно константе равновесия :
Так как это выражение основано на учёте количества реагентов и продуктов реакции, оно является математической записью закона действующих масс для обратимых реакций .
Константа равновесия, выраженная через концентрации реагирующих веществ, называется концентрационнойи обозначается К с . Для более строгого рассмотрения следует вместо концентраций использовать термодинамические активностивеществ а = fC (где f - коэффициент активности). При этом речь идёт о так называемой термодинамической константе равновесия
При малых концентрациях, когда коэффициенты активности исходных веществ и продуктов близки к единице, К с и К а практически равны друг другу.
Константа равновесия реакции, протекающей в газовой фазе, может быть выражена через парциальные давления р веществ, участвующих в реакции:
Между К р и К с существует соотношение, которое можно вывести таким образом. Выразим парциальные давления веществ через их концентрации с помощью уравнения Менделеева - Клапейрона:
pV = nRT ,
откуда p = (n /V )RT = CRT .
Тогда для реакции в общем виде после замены парциальных давлений на концентрации получим
Заменяя выражение (d + с) - (а + b) на равное ему Dn , получим окончательное выражение
К р = К с (RT ) D n или К с = К р (RT ) - D n ,
где Dn - изменение числа молей газообразных веществ в ходе реакции:
Dn = ån i прод (г) - ån i исх (г) ).
Если Dn = 0, т. е. процесс идёт без изменения числа молей газообразных веществ, и К р = К с .
Например, для реакции гидратации этилена, протекающей в газовой фазе:
C 2 H 4 (г) + H 2 O (г) Û C 2 H 5 OH (г) ,
В данном случае Dn = 1 - (1 + 1) = -1. Значит, соотношение между константами может быть выражено таким уравнением:
К р = К с (RT ) - 1 или К с = К р RT .
Таким образом, зная К р этой реакции при каждой данной температуре, можно вычислить значение К с и наоборот.
Размерность констант равновесия зависит от способа выражения концентрации (давления) и стехиометрии реакции. Часто она может вызывать недоумение, например, в рассмотренном примере [моль - 1 м 3 ] для К с и [Па - 1 ] для К р , но в этом нет ничего неверного. При равенстве сумм стехиометрических коэффициентов продуктов и исходных веществ константа равновесия будет безразмерной.